Aantonen van azijnzuur


|
Aantonen van azijnzuur |

|

|
Datum: December 2016 - Januari 2017
Inleiding:
| Via de website van de Koninklijke Bibliotheek vond ik de downloadbare versie van Rompp’s “Organische chemie in een proefbuis”[1], een leuk experimenteerboek. Op p.51 van dat boek werd een aantoningsreactie van azijnzuur besproken die ik niet kende maar waarbij van kristalvorming onder de microscoop werd gesproken (Zie: Achtergrondinformatie). De aantoningsreactie zelf, een reactie met zilvernitraat kwam me niet zo bekend voor aangezien men tegenwoordig een reactie met Ferrichloride als kwalitatieve aantoningsreactie voor carbonzuren gebruikt. Een leuk startpunt voor wat eenvoudige experimenten met organische zuren. |
Materiaal:
|
|
 |
|
| warmhoudplaatje | microscoop camera |
Uitvoering:
|
Aantonen van azijnzuur
Kristallisatie
Ferrichloride reactie
|
 |
|
Referentie experiment
Kristallisatie
Ferrichloride reactie
|
 |
Alle zuren/zouten op de testplaat
|
|
Algemeen: microscopie
Alle microscoop foto’s zijn met een 4x of 10x objectief gemaakt. Visuele observaties met een 10x Oculair. |
 |
Resultaten:
|
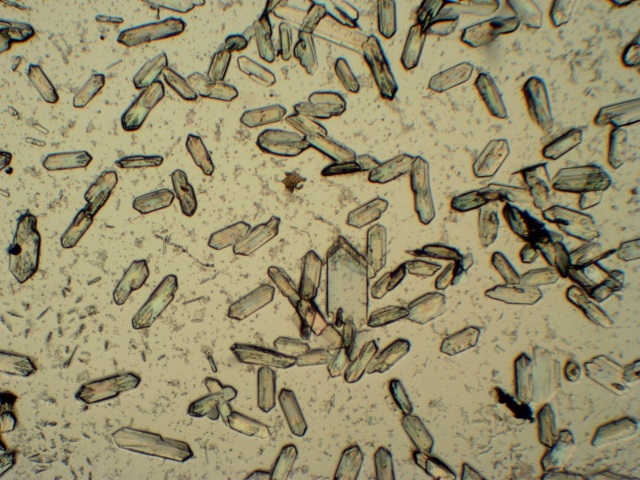
Zilveracetaat – azijnzuur – zonder en met polarisatie (obj. 10x) |
|
 |
|
| Ferrichloride test op geneutraliseerd azijnzuur en een oplossing van natriumacetaat – voor en na verwarming | |
|
|
|
| T.o.v. de Blanco is duidelijke roodkleuring waar te nemen. | |
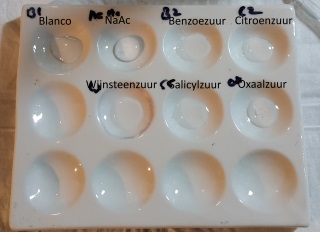
| Druppelplaat reacties met Ferrichloride | |
 |
|
| Zout/Zuur & loog & water | Na toevoegen van Ferrichloride en mengen |
| Op de druppelplaat is te zien dat, met uitzondering van wijnsteenzuur ,alle zuren positief reageren op de Ferrichloride test. Volgens de literatuur had wijnsteenzuur echter ook positief moeten reageren. Ik heb daarom het experiment herhaald met vers wijnsteenzuur en nu is wel een positieve reactie waarneembaar. |
 Herhaalde test met wijnsteenzuur. |
|
Het reactie product van Ferrichloride met
natriumacetaat is Ferriactetaat dat onder de microscoop niet veel structuur
zien. Het gevormde neerslag ziet er amorf uit.
(obj. 4x)
|
 |
Discussie:
| Ferrichloride reactie | |
| De meest benoemde aantoningsreactie voor acetaten/carbonzuren waarbij een neerslag wordt gevormd is de reactie met ferrichloride (FeCl3), waarbij zich een rood-bruine kleur vormt [2-5,9,12]. Hoogstwaarschijnlijk volgens onderstaande reactie, waarbij zich een complex vormt: Fe3+ (aq) + 3 CH3COO – (aq) <=> (CH3COO)3Fe (s) | |
| Zilveracetaat | |
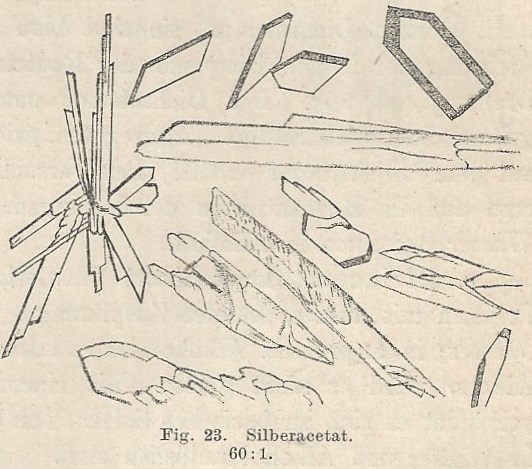
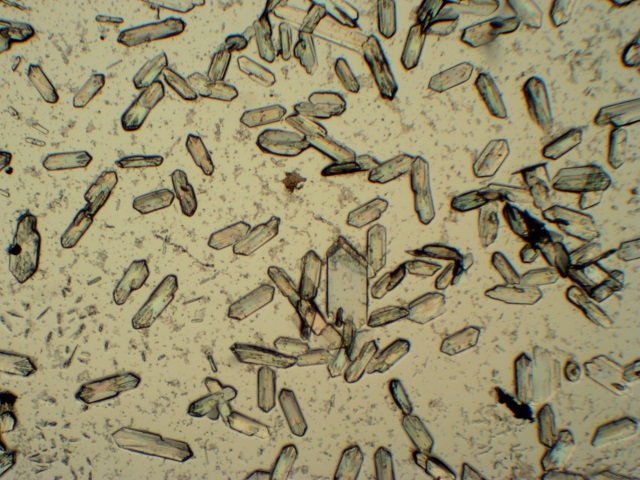
| Voor de reactie met zilvernitraat als aantoningsreactie voor Carbonzuren heb ik dieper moeten spitten in de literatuur. In Behrens [9] wordt de reactie specifiek vermeld als een reactie voor het aantonen van carbonzuren. De illustratie die bijgeleverd wordt komt overeen met wat we waargenomen hebben. Er wordt ook nog extra informatie bijgeleverd nl dat men zeshoekige en ruitvormige kristallen gaat die kunnen samengroeien tot stervormige groepen. De hoek bij de ruiten is 73.5 °. De uitdovingshoek van de prisma’s is 8 °. Al met al is er een goede overeenkomst waarneembaar met de kristallen zoals ze getekend staan in de literatuur en zoals we ze onder de microscoop waarnemen (onderstaande foto, obj. 10x). |
|
 |
|
| De kristallen in bovenstaande foto
zijn typisch ca. 200 micron in lengte (Bandbreedte : 150 - 350 micron)
In het algemeen is er weinig te vinden in de literatuur over zilveracetetaat complexen [6-8], alhoewel de structuurformule wel bekend is [7].
|
|
| De vraag die ik me
eigenlijk stelde is waarom een aantoningsreactie voor organische zuren
die in oudere boeken vermeld wordt, vervangen is door de Ferrichloride
test. De meest waarschijnlijke reden is dat de test niet helemaal
betrouwbaar is. Een aanwijzing daarvoor is te vinden in het artikel van
Giroud en Leblond [6]. Ze beschrijven het aantonen van ascorbinezuur
(Vitamine C) m.b.v. zilvernitraat in dierlijke cellen. Op het einde van
het artikel wordt vermeldt dat onder bepaalde omstandigheden de reactie
een vals negatief resultaat geeft. In het artikel van Halsberghe et al
[11] worden beide reacties besproken, zowel de Ferrichloride als de
zilvernitraat test als een aantoningsreactie voor acetaten. Hierin wordt
ook vermeld dat carbonaten met zilvernitraat een wit amorf neerslag
vormen dat niet onderscheiden kan worden zilverchloride. Dat probleem
lost men dan op door de oplossing aan te zuren maar dan kan men de test
niet meer goed gebruiken om acetaat aan te tonen. Zeker bij micro
chemische analyses, waar de monsterhoeveelheid zeer beperkt is kan dat
een probleem zijn. Uiteindelijk vond ik in een anorganische chemie boek
[12], de beste aanwijzingen waarom deze aantoningsreactie niet meer
gebruikt wordt. In dat boek wordt vermeld:
“AgNO3 Hetgeen ik vertaal als betekenende dat de reactie alleen goed loopt voor geconcentreerd oplossingen en dat ze niet eenduidig is. |
|
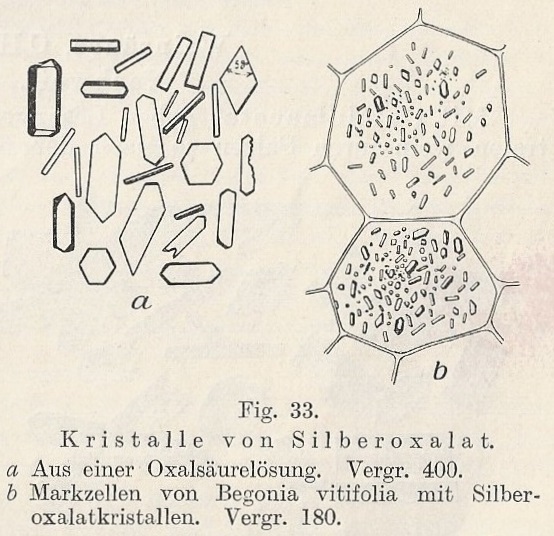
| Zilveroxalaat | |
| De oxalaat kristallen zijn relatief
klein (10x objectief gebruikt)[10].
In beide preparaten zijn de kristallen typisch ca. 30-40 micron in lengte(Bandbreedte: 20-90 micron).
|
 |
| Natriumoxalaat (obj. 10x) | Zilveroxalaat (obj. 10x) |
 |
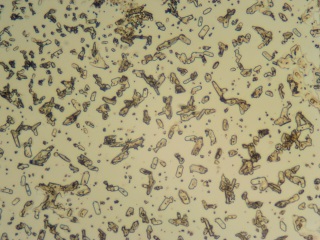 |
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
| Uit het boek van Rompp: | |
|
|
|
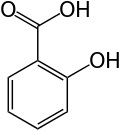
| Structuurformules | |
| Salicylzuur | Oxaalzuur |
 |
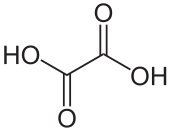 |
| Wijnsteenzuur | Benzoëzuur |
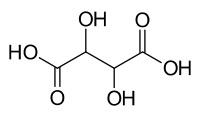 |
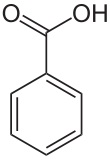 |
| Citroenzuur | Azijnzuur |
|
|
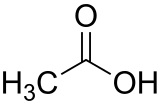 |
20/01/2017