Aluminium-Lucht Batterij


|
Aluminium-Lucht Batterij |

|

|
Datum: januari 2013
Principe:
Elektrochemische Aluminium Koper cel
Materiaal:
|
|
Experimentele opstelling en uitvoering:
|
 |
 |
|
Resultaten:
| Onderstaande foto is een screenshot van het laptopscherm |
 |
| In onderstaande figuur zijn de metingen samengevoegd in een grafiek. |
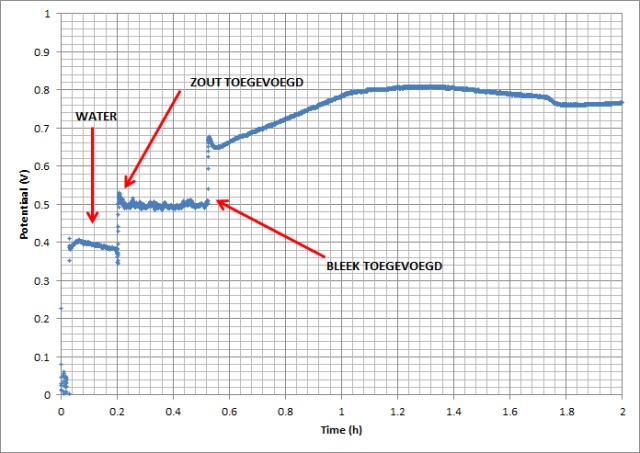 |
| Volgens de literatuur mogen we waardes van ca. 0.5 V (~1 mA) verwachten als we zout toevoegen en ca. 1 V (~10 mA) als we bleek toevoegen. |
Discussie & Conclusie:
Meestal gebruikt men koper en zink in een
batterij, in dit experiment hebben we gebruik gemaakt van koper en aluminium. De
standaardpotentiaal voor koper en aluminium half-cel reacties die dan gebruikt worden
zijn:
Bij 25°C met [Al3+] = 1.0 M en [Cu2+] = 1.0 M. Zn wordt makkelijk geoxideerd door het Cu2+ ion. Een koper-aluminium cel heeft een potentiaal van 2.1 V als de Al3+ en Cu2+ ionen dezelfde concentratie hebben. Met een dergelijk systeem hebben we hier echter niet te maken, het water bevat in eerste instantie geen Al3+ en/of Cu2+ ionen. De potentiaal die we meten komt ook helemaal niet overeen met een dergelijk systeem, we meten een veel lagere potentiaal. In het algemeen zouden we zeggen dat omdat koper elektronegatiever is dan aluminium en de elektronen dus van het koper naar het aluminium stromen in de oplossing. Het systeem waar we hier mee te maken hebben is echter complexer. Het in water opgeloste zuurstof speelt ook een rol. Het zout dat we toevoegen zorgt ervoor dat de oplossing beter gaat geleiden waardoor de ladingen makkelijker door de oplossing getransporteerd worden. Binnenin de cel fungeert het koper als de elektronendonor (kathode) het geeft de elektronen door vanuit het externe circuit. Het in water opgeloste zuurstof wordt door deze elektronen gereduceerd volgens:
Door deze reactie worden OH- ionen gevormd in de nabijheid van de elektrode. Als men de stroom zou meten dan zou men een daling waarnemen. De reden hiervoor is dat in het nauwe gebied rond de koper elektrode de zuurstof opgebruikt wordt, hetgeen met kan herstellen door re roeren. Indien men over een langere periode meet neemt de stroom af omdat de metalen bedekt raken met oxides en andere bijproducten. Het voltage blijft echter wel constant aangezien dat primair bepaald wordt door het verschil in elektronegativiteit van de metalen, hetgeen niet veranderd. Aan de anode wordt het Aluminium geoxideerd volgens:
Het aluminium hydroxide dat gevormd wordt vormt een wit neerslag op de elektrode. De hydroxide ionen die geconsumeerd worden zijn niet dezelfde als geproduceerd worden in de vorige vergelijking (3) en hierbij komt de rol van het zout naar voren. Natrium ionen (Na+) stromen richting de koper elektrode om daar de OH- ionen te neutraliseren, analoog stromen de chloride ionen (Cl-) richting aluminium elektrode om de OH- ionen te vervangen die geconsumeerd worden. Het netto resultaat is dat elektronen bewegen van de koper naar de aluminium elektrode. Als het zout niet aanwezig zou zijn zou de reactie maar gedurende korte tijd lopen door ladingsopbouw op de elektrodes. De combinatie van de halfreacties (3) en (4) geeft de volgende bruto vergelijking voor de cel:
Deze reactie beschrijft de basis van deze cel bij pH = 7. Het koper neemt in feite dus niet deel aan de chemie die plaatsvindt in de cel het is alleen maar een medium voor elektronen transport. De vraag die nog beantwoord moet worden is wat er gebeurt als men Bleek toevoegt. Als men Bleek toevoegt is de batterij niet langer afhankelijk van de zuurstof in de lucht. Het natriumhypochloriet (NaOCl) en hypochloorzuur (HOCl) worden nu gereduceerd. De celpotentiaal is met 3.93 V hoger dan de de 3.12 V van de zoutbatterij. Als men goed oplet kan men ook zien dat er geen Aluminiumhydroxide gevormd wordt. De betreffende reacties zijn:
Betrekken we Aluminium bij de reactie dan krijgen we:
|
Literatuur:
|
Relevante websites:
Minder Relevante websites:
Opmerkingen:
|
Achtergrondinformatie:
|
Om elektrodeprocessen te
kunnen bestuderen moeten we de beschikking hebben over een elektrochemische
cel. Deze bestaat in zijn eenvoudigste vorm uit twee geleiders (elektroden)
geplaatst in een vat gevuld met elektrolytoplossing. Bij stroomdoorgang door
een dergelijke cel moeten aan de elektroden reacties plaatsvinden waarbij de
lading in de vorm van elektronen of ionen het grensvlak elektrode/oplossing
passeert. De elektrode waaraan oxidatie plaatsvindt wordt anode genoemd, de
elektrode waaraan reductie plaatsvindt heet kathode.
Voor de kathodische reactie:
De bruto celreactie wordt dan:
Stroomdoorgang kan alleen plaatsvinden indien er een gesloten circuit bestaat. We moeten beide elektroden daarom uitwendig met elkaar verbinden. Levert een elektrochemische cel bij het tot stand komen van dit elektrisch contact spontaan stroom, dan spreken we van een galvanische cel. In dit geval wordt de chemische energie omgezet in elektrische energie (accu!). Indien daarentegen een uitwendige spanningsbron moet worden aangesloten om stroom door de cel te doen vloeien, dan spreken we van een elektrolytische cel. Hierbij wordt elektrische energie omgezet in chemische energie (accu opladen). De celreactie verschilt alleen daarin van een normale redoxreactie in oplossing, dat de elektronen nu niet direct van het ene deeltje op het nadere worden overgedragen maar via een uitwendig circuit. |
22/07/2013