

| Roest |  |
 |
Datum : augustus 2002
Principe:
| Voor roesten is lucht en vocht nodig, dit kunnen we vrij eenvoudig aantonen. |
Materiaal:
|
|
Procedure:
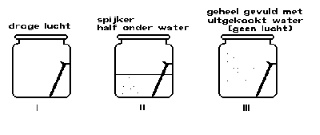 |
|
|
|
Resultaten:
|
|
We kunnen zien dat de spijkers die alleen aan lucht of aan uitgekookt (=ontlucht) water zijn blootgesteld niet zijn gaan roesten gedurende deze korte periode. De spijker die aan de combinatie van kraanwater/lucht (lucht-zuurstof in kraanwater) is blootgesteld is echter heftig gaan roesten. |
|
|
|
|
|
Discussie en conclusies:
|
Vocht, een oxiderend agens, zorgt ervoor dat zuurstof uit de lucht, of degene die in het water is opgelost, het ijzer aantast. Deze oxidatie heet corrosie en bij ijzer spreken we van roestvorming. Alleen water of alleen lucht is niet genoeg om het proces (snel) te laten verlopen, de combinatie echter wel. Roest is geen uniforme substantie. M.a.w.l het is geen zuiver ijzeroxide zoals bv. Fe2O3 of Fe3O4. Roest is een mengelmoes van verbindingen van ijzer, zuurstof en waterstof. Het hoofdbestanddeel is een product dat gelijktijdig een oxide en een hydroxide van ijzer is en waarin het metaal het oxidatiegetal +3 bezit: deze verbinding heeft als somformule: FeO(OH). Verder bevat roest nog water als zodanig, ijzeroxide(n) en hydroxide(n) van andere samenstelling en bovendien ijzercarbonaten - de ijzerzouten van koolzuur (H2CO3), afkomstig van de reactie van ijzer met waterdamp en koolstofdioxide uit de lucht. Koolstofdioxide lost namelijk gemakkelijk op in water. |
Opmerkingen:
|
Literatuur:
|
Achtergrondinformatie:
|
Corrosie kan worden gedefinieerd als een ongewenste (elektro-)chemische aantasting van een materiaal door zijn omgeving. Roesten is de naam van een corrosieproces dat bij ijzer en staal voorkomt. Hierbij wordt roest, een mengsel van ijzerhydroxiden en oxiden, gevormd. Vrijwel alle metalen en hun legeringen zijn onder normale atmosferische condities ontvankelijk voor corrosie. Dit wordt veroorzaakt doordat het reactieproduct, meestal een (hydr)oxide, een lagere vrije enthalpie-inhoud heeft. De vraag die men zich dus moet stellen in deze context is dus niet of er corrosie plaatsvindt maar hoe snel een corrosieproces verloopt. Corrosiereacties spelen zich af aan grensvlakken en kenmerken zich doordat er door het grensvlak ladingsoverdracht plaatsvindt (doorgangsreactie). Bij de corrosiereactie zijn anodische en kathodische deelreacties te onderscheiden. Bij de anode vindt oxidatie plaats (bv Me --> Me2+) terwijl bij de kathode reductie plaatsvindt. De corrosiereactie kan beschreven worden als een elektrochemische cel, de corrosiecel, waarbij in de stationaire toestand de totale anodische stroom gelijk maar tegengesteld gericht aan de kathodische stroom is, de nettostroom is dan gelijk aan nul. De corrosiereactie zelf kan een hoge snelheid hebben, waarbij de snelheid bepaald wordt door thermodynamische en kinetische factoren. Aangezien de activeringsenergie voor de doorgangsreactie be´nvloed wordt door de elektrodepotentiaal is de reactiesnelheid ook afhankelijk van de elektrodepotentiaal. De mengpotentiaal bij een uniform corroderend systeem heeft een waarde die ligt tussen beide evenwichtpotentialen voor de kathodische en de anodische reactie. Beide elektrodereacties zijn gepolariseerd. Voor niet uniforme aantasting zijn lokale verschillen in de elektrodepotentiaal aan het oppervlak van heet corroderende materiaal te onderscheiden. Nu vindt corrosie slechts plaats bij de anodische plaatsen. Afhankelijk van de weerstand van de elektrolytfase wordt een lokale anode be´nvloed door een groter of kleiner deel van het oppervlak van het metaal dat als kathode fungeert. Een zeer klein anodeoppervlak gekoppeld aan een zeer groot kathodeoppervlak, kenmerkt zich door een lage elektrolytweerstand hetgeen tot een ongunstig grote anodische stroomdichtheid leidt. Het gevolg is dat kleine lokale corrosie snel groter wordt. Soms vormen metalen die zeer dunne oxidehuid die het corrosieproces vertraagd. Het vormt een beschermende laag die ervoor zorgt dat de zuurstofionen en de metaalionen elkaar niet kunnen bereiken. Zowel de ionen als de elektronen zouden door deze laag moeten diffunderen hetgeen het corrosieproces dus vertraagd. Metalen die een dergelijke beschermde oxidelaag hebben heten gepassiveerd.
|
17-01-2017