

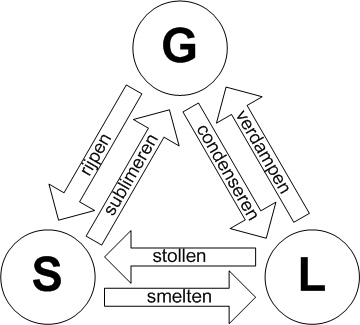
| Sublimatie met mottenballen |  |
 |
Datum: augustus 2002
Principe:
| P-dichloorbenzeen is uitermate geschikt om sublimatie zichtbaar te maken. |
Materiaal:
|
|
Uitvoering:
|
|
|
Resultaat:
|
Binnen het uur kan men de vorming van kristallen op het deksel waarnemen, vooral onder dat deel dat onder het ijsklontje ligt. De kristallen manifesteren zich in twee vormen naalden en vlakke plaatjes met bladachtige strukturen. Onder de polarisatiemicroscoop (De
QX3, enigszins omgebouwd) krijgen we alleen maar zwart-wit verkleuring te zien. |
 |
 |
| zonder polarisatie 10x | met polarisatiefilter 10x |
 |
 |
| met polarisatiefilter 60x | met polarisatiefilter 60x |
 |
 |
| met polarisatiefilter 60x | met polarisator + mica 60x |
Discussie en conclusie:
| Het smeltpunt van p-dichoorbenzeen is 53 ░C. een temperatuur
die we gedurende dit experiment niet bereikt hebben. Desalniettemin worden er
kristallen gevormd op aan de top. Dit wordt veroorzaakt door sublimatie. Sublimatie is het natuurkundige verschijnsel
dat bepaalde stoffen onder bepaalde omstandigheden (temperatuur) van een
gasvormige toestand direct over gaan tot vaste stof of visa-versa. De vloeibare
fase wordt dus overgeslagen. |
 |
| Er zijn meer stoffen die bij verwarming direct
vanuit de vaste stof in dampvorm overgaan. In contact met een koud voorwerp
slaan dergelijke stoffen in kristallijne vorm daarop neer. Zwavel, jodium,
kamfer, coffe´ne, sorbinezuur en benzoŰzuur zijn enkele willekeurig gekozen
voorbeelden van dergelijke stoffen. Indien een monster dat dergelijke stoffen
bevat in een reageerbuis voorzichtig verwarmd wordt, dan ziet men de betreffende
stoffen vaak in het koude gedeelte van de reageerbuis in kristallijne vorm
neerslaan. Sublimatie kan men ook gebruiken om dergelijke stoffen te zuiveren. Dit wordt ge´llustreerd met het fase diagram van water. Via de sublimatielijn gaat water over van vast (S) naar gas (G) vice -versa. De vloeistoffase (L) wordt overgeslagen. |
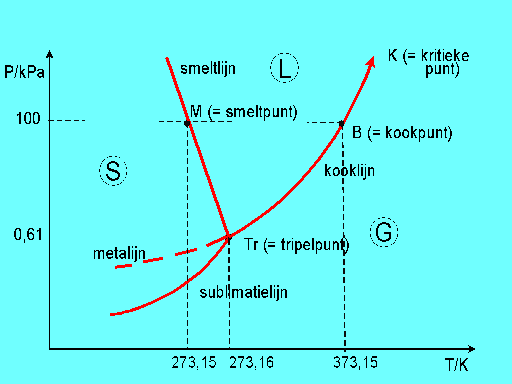 |
| Fase-overgangen: Verschillende fases kunnen naast elkaar bestaan in een systeem. Welke dat zijn is afhankelijk van temperatuur, druk en samenstelling van de diverse fases. Via de grensvlakken tussen de fasen worden voortdurend moleculen uitgewisseld. Als een systeem in (een dynamisch) evenwicht is dan vindt er netto gezien geen stoftransport plaats (gemiddeld in de tijd gezien gaat er evenveel van de ene fase naar de andere fase). Als er geen evenwicht heerst, treedt er net zolang stoftransport op totdat er een stabiele toestand wordt bereikt. Hiermee veranderen dus hoeveelheden en samenstelling van de fases. Als een systeem in een stabiele toestand verkeert, is het aantal fases af te leiden uit de fasenregel van Gibbs: Het aantal vrijheidsgraden wordt gegeven door: F = 2 + C - P (2 wordt gegeven door T en P, C is het aantal componenten en P het aantal fasen). Voor een een componentsysteem (unair) is F dan maximaal 2 en voor een twee componenten systeem is F dan maximaal 3. Zo is dus het driefasesysteem ijs/water/damp alleen dan stabiel als dampdruk en temperatuur een bepaalde waarde hebben omdat F gelijk is aan 0. --> F = 2 + 1 - 3 = 0. Een faseovergang gaat altijd gepaard met veranderingen in een van de toestandsgrootheden van het systeem.
|
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
17-01-2017