Enkele Mikrochemische Experimenten


|
Enkele Mikrochemische Experimenten |

|

|
Datum: Februari - Maart 2020
Inleiding:
| Enkele chemische reacties bekijken onder de microscoop |
Materiaal:
|
Warmhoudplaat |
 |
Camera: Celestron Microscope Imager # 44421 (2 Mp) |
Uitvoering:
| Tenzij anders vermeld, is de werkwijze die gehanteerd wordt vrij eenvoudig. Een druppel van de te onderzoeken oplossing wordt op een objectglaasje geplaatst waarna men het objectglas onder de microscoop positioneert. Met een scherpe pincet wordt vervolgens een kristal of enkel microliters van een reactant naast de druppel gelegd waarna deze onder de microscoop gemengd worden. Als men klaar is met het experiment kan men het water op een warmhoudplaatje afdampen en vervolgens een droog preparaat maken. |
 |
Resultaten:
| Loodjodide kristallen | |
|
Maak een oplossing van loodacetaat door een
stukje lood enige tijd in een oplossing van azijnzuur te leggen. Men kan het
stukje lood eerst dompelen in een waterstofperoxide oplossing alvorens
azijnzuur toe te voegen. Verdun de zo gemaakte oplossing ca. 10 x en plaats
een druppel van de verdunde oplossing op het objectglaasje. Men ziet
onmiddellijk een geel neerslag ontstaan. De onder de microscoop zichtbare
kristallen hebben een hexagonale of rhombohedrische structuur. Reactie: Pb2+ + 2I- --> PbI2 (s) Objectief: 4x |
|
 |
|
| Strontiumoxalaat kristallen | |
|
Maak een strontiumchlorideoplossing in water
en voeg een korrel oxaalzuur toe. Vast oxaalzuur kan men maken door
ontweringswater, dat verkrijgbaar is in de Bouwmarkt, in te dampen. De onder
de microscoop zichtbare kristallen hebben een bipiramidale of prismatische
structuur. In het ingedampte preparaat kan men ook naaldvormige kristallen
waarnemen van oxaalzuur. Reactie: Sr2+ + C2O42- --> SrC2O4 (s) Objectief: 10x |
|
 |
|
| Zilverfosfaat kristallen | |
|
Voeg aan een druppel zilvernitraat oplossing
(1M) een korrel monoammoniumfosfaat (NH4H2PO4)
toe. De gevormde kristallen zij driearmig en ietwat gelig van kleur. Reactie: 3Ag+ + PO43- --> Ag3PO4 (s) Objectief 10x |
|
 |
|
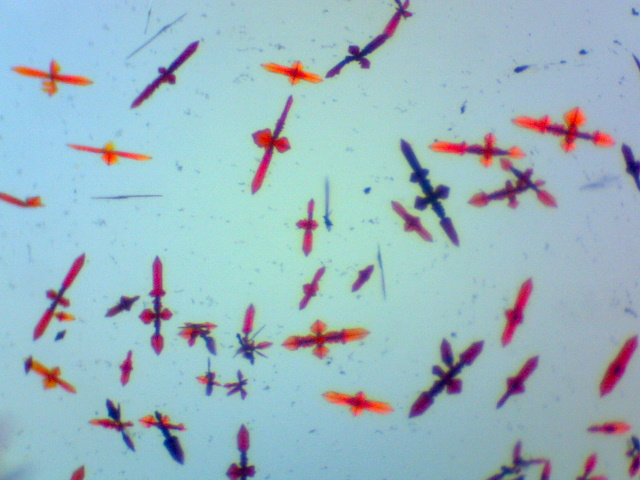
| Zilverchromaat kristallen | |
|
Voeg aan een druppel zilvernitraat oplossing
(1M) een korrel kaliumbichromaat (K2Cr2O7)
toe. De prismatische kristallen zijn rood tot dieprood van keur en vertonen
pleochroïsme (afhankelijk van de kijkhoek veranderd de kleur, vooral onder
gepolariseerd licht). Reactie: 2Ag+ + Cr2O72- --> Ag2Cr2O7 (s) Objectief: 4x |
|
 |
|
| Bariumchromaat kristallen | |
|
Voeg aan een druppel barriumacetaat oplossing
een korrel kaliumbichromaat (K2Cr2O7) toe.
De gevormde rhombische kristallen zijn geel van kleur in de vorm van
rechthoeken en ruiten. Reactie: Ba2+ + Cr2O72- --> BaCr2O7 (s) Objectief: 40x |
|
 |
|
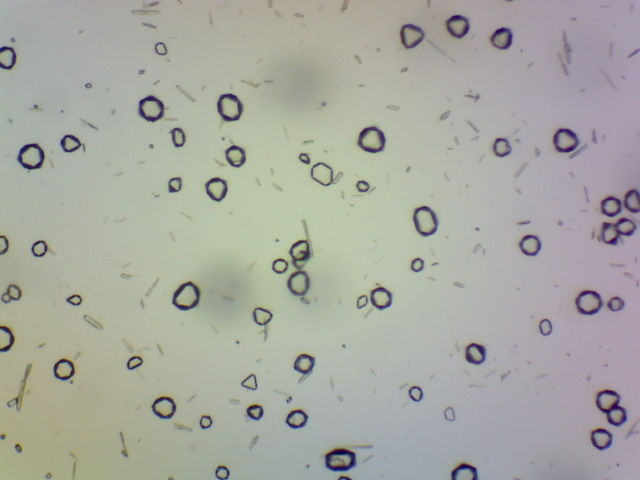
| Ammoniumtinchloride kristallen | |
|
Voeg aan een oplossing van tinchloride (SnCl2)
in verdunde zoutzuur een beetje ammoniumchloride (NH4Cl) toe.
Meng goed en damp deze oplossing in. Er ontstaan octaedrische kristallen. Reactie: Sn2+ + 4Cl- + 2NH4+ --> (NH4)2SnCl4 (s) Objectief: 10x |
|
 |
|
| Boorzuur kristallen | |
|
Een met zoutzuur aangezuurde oplossing van
natriumperboraat (NaBO3.4H2O) wordt ingedampt. Er
vormen zich trikline kristallen. Reactie: BO3- + 3H+ --> H3BO3 (s) Objectief: 10x |
|
 |
|
| Kwikjodide kristallen | |
|
Aan een oplossing van kaliumjodide wordt een
korreltje kwiknitraat toegevoegd. Er vormt zich een oranje neerslag. Er
vormen zich rode tetragonale bipyramide kristallen. Reactie: Hg2+ + 2I- --> HgI2 (s) Objectief: 4x |
|
 |
|
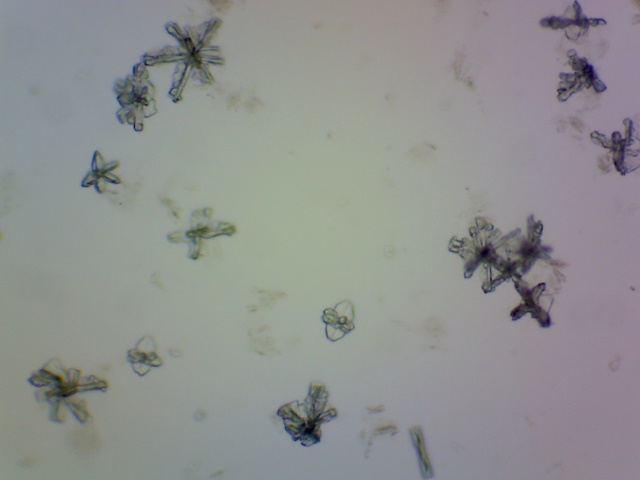
| MagnesiumAmmoniumFosfaat kristallen | |
|
Plaats een druppel magnesiumcarbonaat (MgCO3)
oplossing op een objectglaasje. Voeg veel ammoniumchloride (NH4Cl) en een druppel gec.
ammonia (25%) toe. Meng goed. Plaats een korrel Monoammoniumfosfaat (NH4H2PO4)
in de druppel. Er ontstaan straalsgewijs vergroeide, veervormige kristallen. Reactie: Mg2+ + NH4+ + PO43- --> MgNH4PO4 (s) Objectief: 10x |
|
 |
|
| Kaliumwaterstoftartraat kristallen | |
|
Plaat een druppel kaliumchloride oplossing op
een objectglaasje en voeg enkele korrels wijnsteenzuur toe. Er vormen zich
kleurloze, hemidrische, sterk dubbelbrekende, rhombische kristallen. Reactie: K+ + C4H5O6- --> KC4H5O6 (s) Objectief: 4x |
|
 |
|
Opmerkingen:
|
Literatuur:
|
|
Relevante websites:
Minder relevante website: |
Achtergrondinformatie:
| In de tijd dat we nog niet al die mooie analytisch chemische apparatuur hadden die het mogelijk maakt om een monster van enkele mg volledig te determineren maakte men gebruik van nat chemische methodes. Een voorbeeld dat men zich misschien nog uit zijn schooltijd kan herinneren is het aantonen van zout (chloride ionen) in een oplossing door er een beetje zilvernitraatoplossing aan toe te voegen waarbij zich dan een wit neerslag vormt. Eind 19de en begin 20ste eeuw maakte men voor sporenanalyse gebruik van mikrochemie waarbij een microscoop een onmisbaar hulpmiddel was. De microscoop werd gebruikt om de chemische reacties die in een druppel plaatsvonden te observeren alsmede om de gevormde kristallen te determineren. | |
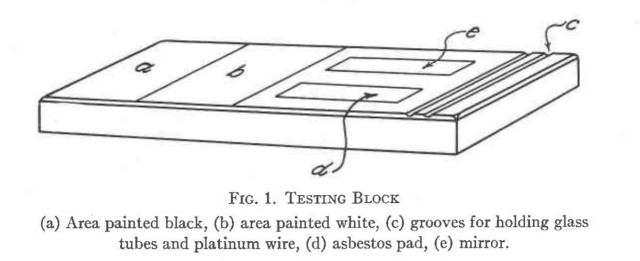
| Werkplank | |
| In het artikel van Staple wordt een werkplank besproken dat handig is bij het uitvoeren van experimenteel werk. Deze werkplank heb ik enigszins gewijzigd nagebouwd. | |
 |
|
 |
|
| Permanente preparaten maken | |
|
|
|
22/03/2020