Calciumoxalaat kristallen


|
Calciumoxalaat kristallen |
 |

|
Datum: Februari 2025
Inleiding:
| Na presentaties over
urineonderzoek en discussies over de oorsprong van calciumoxalaat
in honing vroeg ik me af of ik referentiekristallen kon maken |
Materiaal:
|
|
|
|
 |
|
|
|
Uitvoering:
| Calciumchloride methode | ||
|
 |
|
 |
||
| Oxaalzuur methode | ||
|
 |
|
| Calciumoxalaat kristallen in de buitenste rok van een rode ui | ||
|
||
 |
||
| "Standaard" chemische synthese | ||
|
||
|
 |
|
 |
||
|
||
|
 |
|
| Calciumoxaat in gel | ||
Oxaalzuur in waterglas
|
 |
|
Calciumchloride in waterglas
Oxaalzuur in gelatine
|
||
| Ammoniumoxalaat methode | ||
|
 |
|
Resultaten:
| Calciumchloride methode | |
| Als men het monster kort na menging bekijkt kan men alleen kleine kristallen zien bij grote vergroting (objectief 40x), zoals weergegeven op onderstaande foto. Deze kleine kristallen lijken op de tetragonale calciumoxalaatkristallen die men in urine kan waarnemen (zie nevenstaande foto) |
|
 |
|
| Als men het preparaat na een nacht wederom bekijkt vindt men ook grote kristallen. | |
| Onderstaande foto's zijn genomen met gepolariseerd licht met een 4x en een 10x objectief | |
 |
|
 |
|
 |
|
| Onderstaande foto is genomen met donkerveld en een 10x objectief | |
 |
|
| Bij het herhalen van het experiment krijg ik na een nacht andere kristallen te zien (objectief 10x) | |
 |
|
 |
|
| Oxaalzuur methode | |
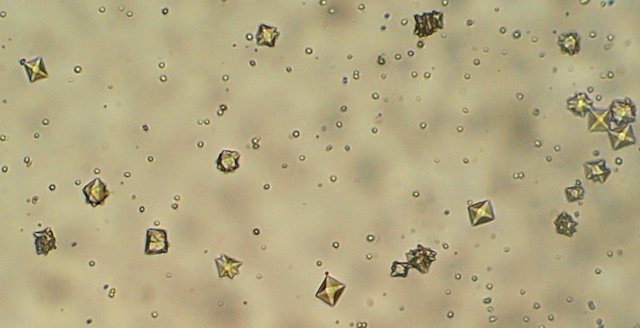
| Als men het monster kort na menging bekijkt kan men ook hier kristallen vinden die lijken op de de tetragonale calciumoxalaatkristallen die in urine gevonden worden (objectief 40x). | |
 |
|
| Na een nacht (objectief 10x) | |
 |
|
 |
|
| Calciumoxalaat kristallen in de buitenste rok van een rode ui | |
| Onder gepolariseerd licht zijn de calciumoxalaat kristallen duidelijk zichtbaar. De slaolie zorgt ervoor dat de rok iets doorzichtiger wordt zodat men de kristallen iets beter kan waarnemen. | |
 |
|
| "Standaard" chemische synthese | |
|
 |
 |
|
| Amorf materiaal onder de microscoop | |
 |
|
| Spot test | |
| Calciumoxaat in gel | |
|
  |
 |
|
|
Resultaten gel experimenten |
|
 |
|
|
Waterglas gel neerslag onder de microscoop (Objectief 10x) (stacked met Picolay) |
|
 |
|
 |
|
|
Gelatine gel neerslag onder de microscoop (Objectief 20x) |
|
| Ammoniumoxalaat methode | |
| Reactie: Ca2+ + 2Cl- + 2NH4+ + C2O42- --> CaC2O4 + 2NH4+ + 2Cl- | |
|
 |
|
|
|
|
|
|
 |
|
 |
|
|
Na een nacht |
|
Discussie en conclusie:
| Calciumoxalaat
kristallen vindt men niet alleen in de urine van niersteenpatienten
maar ook in vele planten. Je ziet eigenlijk nooit dat uien aangetast worden door insecten. De reden is dat het buitenste blad is bedekt met calciumoxalaat (CaC2O4) kristallen, giftig voor mens en dier. |
|
|
Calciumoxalaatkristallen vind men in
zure en neutrale urine. Men identificeert de calciumoxalaat
kristallen in urine via microscopisch onderzoek. Ze zijn
enveloppevormig (octaŽdrisch), een enkele keer hebben ze de vorm van
een zandloper. De kristallen lossen op in HCl maar niet in
azijnzuur.
Nevenstaande afbeeldingen zijn referenties uit de literatuur. In urine is calciumoxalaat vaak aanwezig in de vorm van het dihydraat (tetragonaal). De monohydraat vorm is zeldzaam. |
|
|
De experimenten laten, zoals in de
literatuur vermeld wordt, zien dat de
morfologie van calciumoxalaat kristallen sterk varieert. Volgende de
literatuur wordt de morfologie bepaalt door experimentele condities
zoals reactantconcentraties, temperatuur, de aanwezigheid van andere chemicaliŽn, etc. Dergelijke factoren bepalen de grootte, vorm en zuiverheid van
de gevormde kristallen. De in urine geobserveerde calciumoxalaat kristallen zijn de kleine kristallen die in een aantal syntheses initieel gevormd worden. Het lijkt erop dat deze in urine (gelukkig) zelf niet kunnen uitgroeien naar grotere kristallen zoals we deze geobserveerd hebben (in de nieren zelf wel). En dat is maar goed ook, grotere calciumoxalaat kristallen in de urine zou wel eens heel pijnlijk kunnen zijn. |
|
Opmerkingen:
|
Literatuur:
Relevante websites:
Minder relevante websites: |
Achtergrondinformatie:
| In veel planten kan men anisotrope
structuren vinden waarvan sommige kristallen zijn. In sommige
gevallen kam men deze vinden door een beetje sap te knijpen uit een
steel of stengel In andere gevallen is het noodzakelijk om een dun
plakje te maken dat men bedekt met een dekglas onder de microscoop
kan bekijken.
Sommige van de kristallen die men in planten kan vinden zijn onderdeel van het defensiemechanisme van planten en kunnen schadelijk zijn voor insecten en dieren( ook mensen). Dieffenbachia bevat capsules met kleine naalden erin die een curare achtig gif afgeven als ze geplet worden. Rabarberbladeren bevatten calciumoxalaat kristallen die ook bij mensen gezondheidsproblemen kunnen veroorzaken. Daarom eten we de stelen, niet de bladeren. In planten vindt men naaldvormige kristallen, ruwronde of bolvormige kristallen, langwerpige prisma's, en platte bladvormige kristallen. Een lijst van planten waarin men kristallen kan vinden: iris, oleander, dieffenbachia, ui, vergeet-me-niet, vijfbladerige wingerd, postelein, klaver, lemma, distel, gladiolen, rabarber, fuchsia, sleutelbloem, aster, geranium, esdoorn, hibiscus, en eendagsbloem |
 |
|
Bestanddelen van urinesediment |
| Het maken van vaste preparaten |