De invloed van temperatuur op de fermentatie van gist


|
De invloed van temperatuur op de fermentatie van gist |

|

|
|
|

|
|
|
|
|
|
| In onderstaande grafiek is het resultaat van de experimenten weergegeven als een druk vs tijd diagram voor de verschillende metingen. Bij enkele metingen hebben we i.p.v. 30 minuten, 60 minuten lang gemeten. |
|
|
| Het resultaat is ook beschikbaar als Excel file (2007): analyse.xlsx |
| Deze grafiek laat eigenlijk alleen maar zien dat er bij een hogere temperatuur meer druk dus meer CO2 geproduceerd wordt. De gist is dan actiever. Bij een te lage temperatuur is er nagenoeg geen enkele vergistings activiteit. Volgens de literatuur zou de fermentatie snelheid stijgen bij temperaturen van 10 to 40 oC en bij 50 oC en daarboven weer afnemen. |
|
In de reageerbuis hebben we 3
ml 5% glucose oplossing gemengd met 3 ml gist suspensie. Het
totaalvolume is dan 6 ml. Voor een 5% glucose oplossing geldt: 5% = 5 g/100 ml = 50 g/l = 50/180.16 mol/l = 0.28 M glucose. Deze wordt met een factor 2 verdund hetgeen betekent dat op t=0 de glucose concentratie overeenkomt met 0.14 M. |
|
|
De bruto reactievergelijking
waar we in dit vergistingsproces mee te maken hebben luidt:
C6H12O6 --> 2 CH3CH2OH
+ 2 CO2
+ energie ! mol glucose levert dus 2 mol ethanol en 2 mol CO2. |
|
| De productie van CO2 leidt tot de druktoename die we meten met de drukmeter. Volgens de gaswet (pV=ZnRT) is mol productie van CO2 dus recht evenredig met de druktoename. De snelheid van de druktoename is dientengevolge een maar voor de reactiesnelheid en deze kunnen we uit bovenstaande grafieken afleiden door de hellingshoek te bepalen in een lineair deel van de grafiek (r = DP/Dt). Het resultaat is weergegeven in nevenstaande tabel en onderstaande grafiek. |
|
|
|
|
|
Het liefst hadden we meer datapunten gehad in deze grafiek
(andere temperaturen) maar aangezien we maar beperkte
mogelijkheden hebben om de temperatuur constant te houden is dat
niet gelukt. Ik heb dit wel geprobeerd door metingen uit te voeren
terwijl het waterbad af een het koelen was of op aan het warmen en
vervolgens de gemiddelde waarde te nemen, maar dit werkte niet goed. |
|
|
Temperatuur veranderingen hebben
een sterk effect op levende organismes. Vooral enzym gekatalyseerde
reacties zijn bijzonder gevoelig voor kleine veranderingen in de
temperatuur. Om deze reden wordt het metabolisme van de poikilothermen (organismes waarvan de interne lichaamstemperatuur
bepaald wordt door hun omgeving) bepaald door hun
omgevingstemperatuur. Van deze eigenschap die gisten hebben maakt
men dan weer gebruik van bij bakkersgist. De door het bakkersgist
geproduceerde CO2 zorgt ervoor dat het brood gaat rijzen
en zo luchtig wordt.
De vergistingreactie die we hier
bestudeerd hebben is uitgevoerd onder anaerobe condities, onder
uitsluitsel van zuurstof, waarbij de glucose moleculen omgezet
worden in ethanol, CO2 en energie volgens: |
| Reactievergelijking: C6H12O6 --> 2 CH3CH2OH + 2 CO2 + energie |
| De geproduceerde energie komt overeen met 2 ATP moleculen. |
|
In aanwezigheid van zuurstof (aeroob)
zou er een andere reactie plaatsvinden:
Reactievergelijking: C6H12O6
+ 6 O2 --> 6 H2O
+ 6 CO2
+ energie De geproduceerde energie komt dan overeen met 36 ATP moleculen. In deze reactie zouden we echter geen drukverandering waarnemen aangezien het netto effect van productie en afname van gasmoleculen 0 is. |
| In dit experiment zien we alleen maar een toename van de reactiesnelheid. Volgens de literatuur zou de fermentatie snelheid stijgen bij temperaturen van 10 to 40 oC en bij 50 oC en daarboven weer afnemen. Die afname hebben we in dit experiment niet waargenomen aangzien we niet boven de 50 oC zijn geweest. |
|
|
|
| Gisting | |
|
Gisting is het proces waarbij energie
uit voedsel wordt vrijgemaakt door een chemisch proces waarbij
geen zuurstof aan te pas komt. Het voedsel, bv een koolhydraat,
wordt niet volledig afgebroken tot CO2 en H2O maar, tot kleinere
organische moleculen zoals alcohol, melkzuur of boterzuur.
Aangezien de afbraak onvolledig is komt er bij gisting
(anaeroob) minder energie vrij dan bij ademhaling (aeroob).
Gisting en ademhaling kunnen tegelijkertijd in dezelfde cel
plaatsvinden. Tijdens hevige spieractiviteit kan de
zuurstofvoorziening wel eens onvoldoende zijn om alle voedsel te
oxideren en aan de energiebehoefte te voldoen. Dan wordt er
energie vrijgemaakt uit glucose door de melkzuurgisting:
1 mol glucose --> 2 mol melkzuur + 76
kJ
Dit melkzuur wordt geoxideerd tot of
weer in koolhydraat omgezet nadat de hevige activiteit is
afgelopen; dus de zuurstof-opname gaat nog een tijdlang extra
snel (nahijgen). Men zegt dat organisme een ''zuurstofschuld"
heeft t.g.v. van de gisting. Bepaalde bacteriën, zoals de melkzuurbacteriën (waaraan we zure melk, karnemelk, yoghurt en zuurkool danken) en schimmels krijgen al hun energie, of een groot deel ervan uit gisting. Sommige van deze bacteriën kunnen zelfs niet ademen, en zuurstof is vergif voor ze. Alcoholische vergisting op industriële schaal wordt meestal teweeggebracht door gisten die inwerken op suikeroplossingen zoals vruchtensap en mout: C6H12O6 --> 2 CO2 + 2 C2H5OH + 118 kJ Als de gistingsproducten, in dit geval alcohol, niet verwijderd worden, bereiken zij een concentratie waardoor het gistend organisme gedood wordt. Vandaar dat wijn nooit sterker kan zijn dan 13% alcohol. Bij het bierbrouwen laat men eerst gerst ontkiemen en hierbij wordt het zetmeel omgezet in maltose. De kiemende gerst wordt gedood en de maltose wordt er met water aan onttrokken. Aan deze oplossing wordt gist toegevoegd, die de omzetting tot alcohol en koolstofdioxide veroorzaakt. Bij het maken van bier wordt hop toegevoegd om er een bittere smaak aan te geven. en de vloeistof wordt dan onder druk gebotteld zodat het CO2 behouden blijft. Veel vruchtensappen gisten spontaan als men de stuk gedrukte vruchten in daartoe geëigende omstandigheden laat staan en de gistplekken die op de schillen aanwezig zijn, zich laat ontwikkelen. Als er teveel zuurstof wordt toegelaten of als er de verkeerde gistsoorten, samen met fungi en bacteriën, erin komen, dan kan de oxydatie van de alcohol doorgaan totdat er azijnzuur wordt gevormd, zoals in azijn. Bij het bakken wordt gist gebruikt om voor het bakken het deeg te laten "rijzen" door de koolstofdioxide belletjes die afgegeven worden. Door de vitaminen van het B-complex die erin aanwezig zijn, is de gist zeer waardevol bij de genezing van vitamine-tekorten. |
|
|
Gisten
De gistsoorten vormen een zeer ongewone familie der fungi. Slechts enkele van de talrijke soorten kunnen echte zwamdraden vormen; de meeste bestaan uit afzonderlijke, bolvormige cellen, die men slechts onder de microscoop kan zien. Gisten zijn eencellige micro-organismen met een grootte van circa 0,005-0,020 mm. Anders dan bacteriën hebben gistcellen hun DNA in de celkern opgeborgen; dat hebben zij gemeen met planten, dieren en mensen, waardoor zij ingedeeld zijn bij de eukaryote organismen. De gistcellen zijn opgebouwd uit een dunne celwand die het protoplasma omsluit. In het midden van het protoplasma bevindt zich een vacuole. Een speciaal protoplasmakorreltje, de nucleolus, is hieraan bevestigd en men neemt aan dat deze beide delen, vacuole en nucleolus, de kern vormen. In het protoplasma liggen korreltjes glycogeen en ander reservevoedsel. De cellen planten zich voort doos spruiting of knopvorming, waarbij een uitstulping van de cel groter wordt en ten slotte als een onafhankelijke cel van de ouderplant wordt afgesnoerd. Als de knopvorming niet snel plaatsvindt, laten de afzonderlijke cellen niet direct los en het gevolg hiervan is, dat men soms groepjes aan elkaar vastzittende cellen kan zien. |
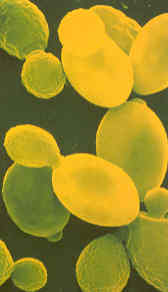 De foto laat gistcellen onder de microscoop zien. Eén gram gist bevat er ongeveer vijftien miljard van. |
| Onder bepaalde omstandigheden kunne twee cellen copuleren dwz ze verenigen zich en de inhoud van de beide cellen versmelt. Later deelt deze celinhoud zich in vier afzonderlijke cellen die elk een dikke wand ontwikkelen. Dit zijn sporen en ze kunnen een ruststadium vormen. Als de oude celwand die ze omsluit, openbreekt, komen de sporen vrij en groeien uit to normale, knopvormige cellen. Zulke sporen ontstaan dikwijls zonder enige voorafgaande copulatie. | |
|
Naam:
glucose Triviaalnamen: druivesuiker, dextrose, aldohexose Formule: C6H12O6 Molmassa: 180.16 g/mol |
|
||||
Enzymkinetiek
De vergistingsreactie
verloopt aangezien er enzymen aangemaakt worden die ervoor zorgen
dat de reacties kunnen verlopen.
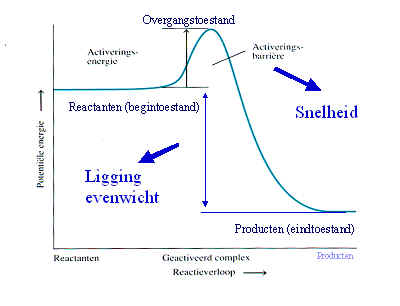
Een enzym is een eiwit met
katalytische eigenschappen, vanwege hun vermogen om specifieke
bindingen te activeren (de activeringsenergie wordt verlaagd).
|
|||||
|
Een enzym heeft naast een
eiwitgedeelte (het apo-enzym) vaak nog een andere bouwsteen (de
cofactor) nodig voor de katalyserende functie. Het geheel noemt
men holo-enzym.
Als cofactor kunnen optreden
metaal-ionen (bv Ca2+) of een complex organisch
molecuul dat als coenzym functioneert bv NADH
De enzymkinetiek gedraagt
zich niet wezenlijk anders dan de normale chemische kinetiek. Vaak
heeft men te maken met pseudo-1ste-orde kinetiek (bv
als in een 2de orde reactie een de concentraties zeer
hoog is en de andere concentratie zeer laag).
In een 1ste orde
reactie is de reactiesnelheid evenredig met de concentratie van
een reactant.
Voor de reactie: S -->
P
Geldt dan:
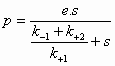 (4)
De initial velocity
(reactiesnelheid op t=0) wordt bepaald door de productvorming uit
ES:
(4)
De initial velocity
(reactiesnelheid op t=0) wordt bepaald door de productvorming uit
ES:
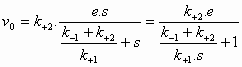 (6)
De maximale reactiesnelheid
(Vmax, S à
(6)
De maximale reactiesnelheid
(Vmax, S à
|
|||||