

| Zelf zeep maken |
 |
 |
Datum: oktober 2004
Principe:
Zeep maken mbv vet/olie en loog.
Materiaal:
|

|
Uitvoering:
Draag handschoenen en
een veiligheidsbril bij het toevoegen van de loog.
|
Resultaten:
| MET SOJAOLIE | |||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||
Discussie en conclusie:
Dit type reactie noemt men een saponificatie reactie die verloopt zoals hierbeneden is weergegeven.
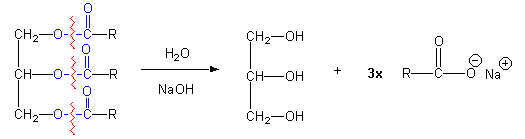
Zepen zijn in feite de zouten van vetzuren. Het homogeen mengsel dat ontstaan is nadat de verzeping is voltooid, het mengsel van zeep, glycerol en water noemt men zeeplijm. Het scheiden van de zeep van de glycerol en de eventueel aanwezige verontreinigingen heet uitzouten. We maken hier gebruik van de omstandigheid dat zeep onoplosbaar is een geconcentreerde keukenzoutoplossing (pekel). Als aan de zeeplijm pekel wordt toegevoegd ontstaat een bovenloog van voornamelijk zeep en water en een onderloog van glycerol, zout en water.
Bij het echte fabricageproces herhaalt men het uitzout proces enkele malen. Na het wassen wordt de ruwe zeep afgewerkt waarbij men onder toevoegen van water en kleine hoeveelheden loog de zeep nogmaals opgekookt. Het doel is om de resten glycerol en de verontreinigingen uit de zeep te extraheren. Na enige dagen staan vormt zich een zeeprijke laag, kernzeep genaamd en een donkere zeeparme laag, de bodem, die de verontreinigingen bevat. De grenslaag heet niger.
Pure zeep (bijv. natriumstearaat) maakt goed schoon, maar heeft een hoge pH-waarde (is basisch) en kan hierdoor oppervlakken (huid, kleding) beschadigen. Om dit te voorkomen worden vaak mengsels van zeep met andere (niet-ionogene) oppervlakte actieve stoffen gebruikt (alcoholen, polyethyleenglycolen, tetraalkylammonium zouten). Deze laatste zijn (nagenoeg) neutraal in oplossing maar verlagen de oppervlaktespanning van het water ook, en verhogen hiermee de schoonmaakkracht er van. De wasmiddelen van tegenwoordig bevatten hiernaast vaak ook enzymen die in staat zijn tot het (gedeeltelijk) afbreken van vetten en eiwitten. De meeste schoonmaakmiddelen zijn dus eigenlijk geen pure zeep meer en de waskracht is van een heleboel andere toevoegingen afhankelijk.
Vaak maken de agressievere zepen beter schoon, maar beschadigen ze het schoon te maken oppervlak ook. Om hier achter te komen zul je de schoonmaakhandeling heel vaak moeten herhalen op hetzelfde oppervlak. Fabrikanten zoeken meestal de combinatie van mild en krachtig in het schoonmaken. Twee eigenschappen die vaak moeilijk te verenigen zijn.
De zeep die we hier gemaakt hebben is erg basisch en is dus niet geschikt om je handen mee te wassen.
Je kunt bij dit experiment ook zien dat als we een vet ipv een vloeistof gebruiken het rendement hoger is.
Opmerkingen:
Literatuur:
Relevante websites:
Achtergrondinformatie:
|
Het maken van zeep is in principe niet moeilijk. Men heeft slechts vetten of oliŽn nodig, die van planten of dieren afkomstig kunnen zijn, die met loog gekookt dienen te worden. Loog in zijn eenvoudigste vorm is een oplossing van soda. Soda kan men in warme droge streken, zoals in het Nabije Oosten aan de rand van de zogenaamde Bittermeren, zomaar opscheppen. Vetten en oliŽn kan men opvatten als verbindingen van organische zuren (zogenaamde vetzuren) met glycerine. Bij het koken met loog wordt de glycerine verdringen door het loog en ontstaat een mengsel van water, glycerine en zeep. Dit alles klinkt eenvoudig maar het mengsel is nog altijd geen zeep, het lijkt meer op een vreemd soepje. Om de zeep werkelijk in handen te krijgen moet men aan het "soepje" nog pekel toevoegen (een geconcentreerde zoutoplossing), waarna de zeep zich afscheidt in de vorm van een vaste bovenlaag. De Romeinse generaal Plinius de Oudere (rond het jaar 50) vond bij de GalliŽrs en de Germanen een roodkleurig product dat werd bereid uit het nierenvet van geiten en de as van beukenhout. Pas in het jaar 165 vermeld de Romeinse geneesheer Galenus dat men met zeep ook de haren kan wassen. In eerste instantie hadden de Arabieren een grote voorsprong op het westen aangezien bij hen de soda voor het oprapen lag. Pas in 1775 werd in Frankrijk een prijsvraag uitgeschreven hoe men soda uit keukenzout kon bereiden. Een zekere Le Blanc won de prijs. Uiteindelijk vond in 1861 een Belg, Ernest Solvay, een betere methode om soda te maken en werd het mogelijk om op een goedkope manier zeep te maken. |
|
Detergentia
(waaronder ook de zepen vallen) bestaan uit lange moleculen waarvan we
gemakshalve zeggen dat ze een kop en een staar hebben. De kop is polair en
zit daarom graag in water (dat ook polair is) terwijl de staart apolair is
en daarom juist niet graag in water zit. Men spreekt ook wel van hydrofiel
(zit graag in het water) en hydrofoob (zit juist niet graag in water).
Het kenmerk van deze stoffen is dus dat ze bij voorkeur op het
grensvlak van niet-mengbare stoffen gaan zitten (bv olie/water). De staart
hangt dan in de apolaire stof (de olie) terwijl de kop in het polaire
water hangt. Men noemt deze stoffen dan ook weíll oppervlakte actieve
stoffen en in het engels "surfactants".
Chemisch
gezien kunnen we bovenstaand gedrag op verschillende manieren voor elkaar
krijgen. Voor het apolaire deel (R) volstaat het om een lange alkaan keten
ter beschikking te hebben {(CH2)n}. Bij de polaire
kop heeft men echter meer mogelijkheden. Men spreekt van anionische detergentia indien deze kop negatief geladen (bv R-SO3- of R-COO-) is en kationische detergentia indien deze positief geladen is.
Het
contact met water kan op twee manieren plaatsvinden omdat het
watermolecuul een dipoolmoment (een zwakke ladingsverdeling)
bezit ( de O is - en de H's zijn +). Bij anionische detergentia zal
het water rond de kop dus voornamelijk via's de H's uitgelijnd zijn. |
|
| Detergentia verlagen de oppervlaktespanning door zich aan het oppervlak te concentreren. Deze verlaging is de basis voor de werking van wasmiddelen. De oppervlaktespanning wordt ongeveer net zo groot als die van vet en vuil waardoor deze verontreinigingen in het waswater kunnen worden opgenomen. De lange koolwaterstofketens van de zeepmoleculen of -ionen zijn slecht oplosbaar in water (ze zijn hydrofoob). Ze kunnen hun energie verlagen door door met de lucht naar het oppervalk te bewegen. Daar is schuimvorming een mogelijkheid om het grensvlak vloeistof-lucht te vergroten. De warmtebeweging van de moleculen heeft echter de neiging ze uniform door de oplossing te verspreiden. Er ontstaat dan een evenwicht waarbij de concentratie van zeepmoleculen aan het oppervlak groter is dan in de bulk. | 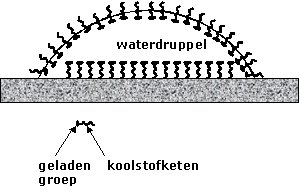 |
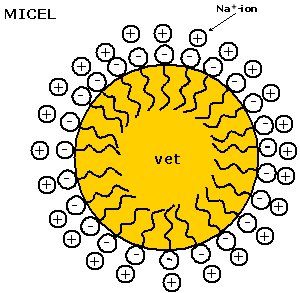
| Zeepmoleculen zijn
anorganische detergentia waarbij het hydrofiele deel meestal aan
carboxylaat groep is (COO-). Bij moderne wasmiddelen is het
meestal een sulfonaatgroep (SO3-). Doordat de
hydrofobe staart meer affiniteit heeft met het (apolaire) vet wordt het
vetdeeltje volledig ingekapseld door de zeepstaarten. Er ontstaat een
micel. Een micel is een vetbolletje dat door de naar buiten gerichte
hydrofiele groepen oplosbaar in water is geworden.
OliŽn en vetten zijn esters van glycerol (1,2,3-propaantriol) en vetzuren (carbonzuren met lange koolstofketens). Vetten zijn vast en oliŽn zijn vloeibaar. Aangezien de meeste oliŽn en vetten tri-esters van glycerol zijn worden ze ook wel triglyceriden genoemd. |
 |
13-01-2008