Verdamping van
vloeistoffen
(CoachLab
Experiment)


|
Verdamping van
vloeistoffen |
 |
 |
Datum: augustus 2004
Principe: Een temperatuur sensor gebruiken om het effect van verdamping op de temperatuur vast te stellen voor verschillende vloeistoffen.
Materiaal:
|
|
Uitvoering:
|
|
|
|
|
|
|
|
|
|
|
|
|
Resultaten:
|
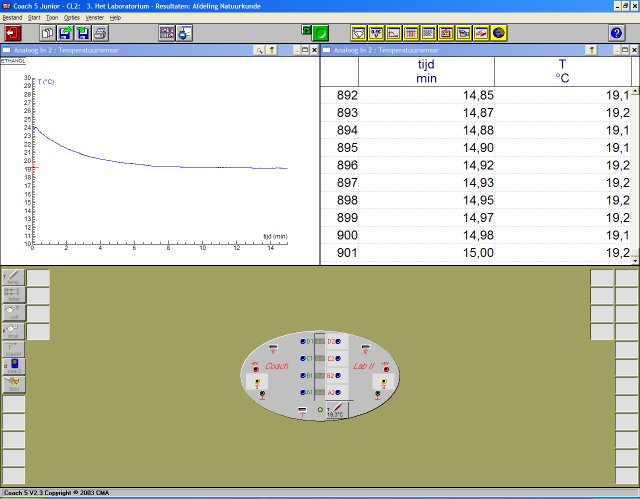
De txt resultaat files die geŰxporteerd werden
uit CoachLab na elke meting zijn vervolgens in een excel sheet ge´mporteerd (resultaten.xls)
waarna de meetresultaten grafisch uitgewerkt werden zoals weergegeven in onderstaande
grafiek: |
|
|
| Analyseer de meetresultaten
tevens op de behaalde minimum en maximum temperatuur en bereken het
temperatuurverschil.
Het resultaat is samengevat in onderstaande tabel. |
|
|
Discussie:
|
Verdamping is een endotherm proces waarvoor warmte nodig is. Die warmte wordt onttrokken van de omgeving hetgeen resulteert in een temperatuurdaling die we dus meten. Door de manier waarop we het experiment opgezet hebben gaan we ervan uit dat we iedere keer ongeveer dezelfde hoeveelheid materiaal opnemen in de tissues. De vraag is nu of we een relatie kunnen vinden tussen een of meerder eigenschappen van de stoffen die we gemeten hebben en de temperatuurdaling die we gemeten hebben. Intu´tief denken we dan als eerste aan het kookpunt. Zetten we dit nu grafisch uit dan krijgen we onderstaande grafiek. |
|
| Vergelijken we nu thinner/wasbenzine met water dan lijkt dat aardig op te gaan. Aceton heeft een veel lager kookpunt, verdampt dus makkelijker/sneller, daarvoor is veel warmte nodig. De temperatuur daalt dan het verst, de aceton is echter ook sneller helemaal /grotendeels verdampt waardoor in de tijd gezien de temperatuur ook sneller begint te klimmen. | 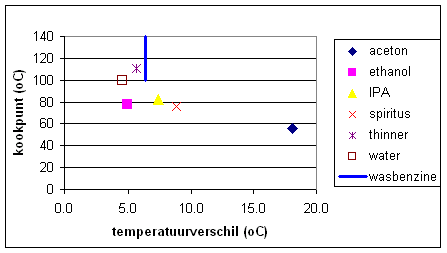 |
| Met
deze redenatie kunnen we ook de vorm van de curve verklaren. We kunnen op basis van dit experiment niet concluderen dat er een significant verschil is tussen de thinner en de wasbenzine. De stoffen die we in bewerking hebben genomen zijn handelsoplossingen waarvan we alleen maar een globale omschrijving hebben of alleen maar de hoofdcomponent kennen. Onzuiverheden en een andere samenstelling kunnen het kookpunt be´nvloeden. Voor wasbenzine hebben we slechts een range tot onze beschikking en geen gemeten kookpunt. Ook kunnen er nog kleine verschillen zijn in de hoeveelheid materiaal die we in bewerking hebben genomen. We zien echter ook duidelijk in de grafiek dat de relatie tussen kookpunt en temperatuurdaling niet opgaat voor de alcoholen en het water. De mate waarin de temperatuur daalt is, zoals aan bovenstaande resultaten te zien is afhankelijk van de stof die men gebruikt en wordt dus bepaald door bepaalde eigenschappen van die stoffen. Naast het kookpunt en viscositeit kunnen we echter ook denken aan intermoleculaire aantrekkingskrachten zoals bv waterstofbrugvorming (H-brug), deze laatste heeft ook invloed op de viscositeit. Indien er waterstofbrugvorming kan optreden "klitten" de moleculen beter aan elkaar, de oplossing wordt "stroperiger" (viscositeit) en verdampt moeilijker. |
|
| Een grootheid waarmee we het
dipoolmoment kunnen uitdrukken is de Debye. In nevenstaande tabel hebben we de belangrijkste getallen gerangschikt. |
|
| Zouden
we alleen het kookpunt hanteren dat zouden we verwachten dat ethanol door
verdamping een groter temperatuurverschil zou creŰren dan isopropanol.
Aan het verschil in dipoolmoment tussen water en ethanol kunnen we zien dat
een groter dipoolmoment meer waterstofbrugvorming impliceert (of sterkere
bindingen). Het verschil in kookpunt tussen ethanol en IPA is relatief
klein, het verschil in dipoolmoment is echter relatief groot. Ethanol, net
als water heeft een groter dipoolmoment heeft dan IPA. Het lijkt er dus op
alsof een lager dipoolmoment leidt tot meer vluchtigheid.
Op basis van deze metingen zijn geen spijkerharde conclusies te trekken over de relaties die we gelegd hebben. Meer experimenten zouden nodig zijn om dat te bewijzen. Ze zijn op zijn minst echter sterke aanwijzingen. |
|
Conclusie:
|
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
Elektrische eigenschappen van moleculen. Een elektrische dipool is opgebouwd uit twee ladingen q+ en q- die van elkaar gescheiden zijn door een afstand l en wordt weergegeven door een vector u die in de richting van de negatieve naar de positieve staat. De grootheid van de vector is ql en wordt het elektrisch dipoolmoment (m) genoemd. Een heteronucleair diatomisch molecuul, opgebouwd uit twee verschillende elementen (bv CO en HCl). De elektronenverdeling in de covalente binding tussen de atomen is echter niet symmetrisch aangezien het energetisch gezien gunstiger is voor het elektronenpaar om dichter bij het ene atoom te zitten dan bij het andere. Deze onbalans resulteert in een polaire binding, een covalente binding waarbij een elektronenpaar ongelijk verdeeld wordt tussen twee atomen. Als het elektronenpaar nu dichter bij een atoom zit (bv de Cl in HCl) dan ontstaat daar een netto negatieve lading (d-) die weer gecompenseerd wordt door een netto positieve lading op het H-atoom (d+). |
|
| Een polair molecuul is een
molecuul met een permanent elektrisch dipoolmoment dat ontstaat door de
kleine ladingen op atomen die verbonden worden door polaire bindingen. Een
dipoolmoment kan ook ontstaan (of geneutraliseerd worden) als een molecuul
zich in een elektrisch veld bevindt. Dan spreekt men van een ge´nduceerd
dipoolmoment
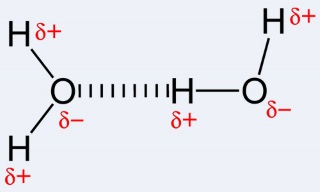
In water maar ook in alcoholen bevat het O een d- lading en het H een d+ lading. Alhoewel het molecuul in zijn geheel is elektrisch neutraal is kunnen de d+ lading van een H-atoom en de d- lading van een O atoom van verschillende moleculen elkaar aantrekken. Er wordt op deze manier een zwakke binding gevormd tussen de moleculen onderling. Men spreekt dan van een waterstofbrug. |
 |
12-01-2017