Kleurstofontleding Colorimetrisch bestuderen mbv CoachLab


|
Kleurstofontleding Colorimetrisch bestuderen mbv CoachLab |
 |
 |
Datum: april 2006
Principe:
| M.b.v. een Coachlab colorimeter en CoachLab bekijken we het effect dat bleekmiddelen op kleurstoffen hebben. |
Materiaal:
|
|
||
|
|
|
|
|
Uitvoering:
|

|
|
|
|
|
|
Meetresultaten:
|
Alle data en bewerkingen zijn te vinden in
de excel file: resultaten.xls
In de grafieken hierbeneden worden alle meetresultaten na correctie voor het watersignaal (blanco) weergeven. We verwachtten dat na het toevoegen van de bleekmiddelen er ontleding van de kleurstof zal plaatsvinden zoals we in een eerder experiment met kleurstof al eens hebben waargenomen. De vloeistof zal dan helderder worden en de Extinctie daalt dan omdat er minder licht geabsorbeerd wordt. |
|
|
|
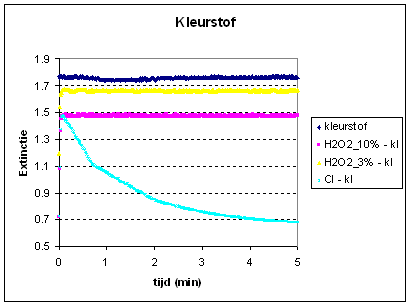
Alleen bij de peroxide nemen we waar dat na een aanvankelijke stijging de extinctie daalt. Na het toevoegen van Glorix zien we in eerste instantie alleen maar een stijging. Herhalen we dat laatste experiment dan krijgen we na een stijging een plotselinge flinke daling te zien. Deze meetresultaten kunnen we verklaren als we na de meting de cuvet goed bekijken. Zie de foto's hierbeneden. |
| We zien dat er een soort twee fasen systeem is gevormd waarbij vaste deeltjes naar boven gedreven zijn. Het lijkt wel alsof er eiwit denaturatie heeft plaatsgevonden. Het signaal dat we in het tweede experiment zagen was dus in eerste instantie de vorming van vaste deeltjes waardoor lichtverstrooiing plaatsvindt en de extinctie stijgt, gevolgd door een plotselinge segregatie. De uiteindelijke extinctie is lager dan die van het sap hetgeen klopt met de waarneming dat de oplossing helderder is geworden. Door deze neerslagvorming is deze methodiek echter niet geschikt om kinetische experimenten te doen. Het waterstofperoxide signaal is ook niet goed verklaarbaar. Alhoewel er na de initiŽle stijging een daling heeft plaatsgevonden zien we ook in de laatste minuut het de extinctie constant blijft. Deze waarneming is niet consistent met een ontledingsreactie. Kijken we nog eens goed naar de cuvet dan zien we een sliertje van een eiwitachtige verbinding in de vloeistof drijven. Na schudden van de grape juice fles konden we deze slierten in de hele oplossing waarnemen. Bij het vullen van de cuvetten hebben we erop proberen te letten dat we niet zulk een sliertje meenamen maar zo te zien is dat noet goed gelukt. We kunnen dus alleen maar concluderen dat de rode kleurstof in grape juice sap niet ontleedt tgv blootstelling aan waterstofperoxide. | |
|
|
|
|
Aan de hoge extinctie van de signalen kunnen we zien dat we bij de kleurstof met een veel geconcentreerder oplossing te maken hebben. We zien hier echter ook weer dat de kleurstof alleen ontleedt tgv glorix oftewel blootstelling aan actieve chloor. |
|
|
|
Discussie:
| We zien aan de experimentele resultaten dat
er uiteindelijk maar een experiment geschikt is voor de kinetiekanalyse, het
experiment waar we Glorix hebben toegevoegd aan de rode kleurstof. De vraag is
nu of de ontleding die we gemeten hebben verloopt volgens 1ste orde kinetiek. De
formule die 1ste orde kinetiek beschrijft is in
"achtergrondinformatie" afgeleid:
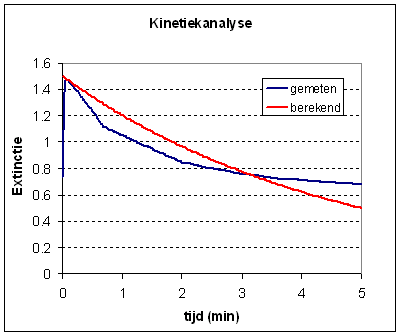
waarin C de actuele concentratie is, C0 de aanvangsconcentratie, k de reactiesnelheidsconstante en t de tijd is. De aanvangsconcentratie weten we echter niet en daarom passen we een vereenvoudiging toe. Volgens de Wet van Lambert-Beer (E=k.l.c) is de extinctie recht evenredig met de concentratie. Door dus de extinctie als functie van de tijd te plotten kunnen we deze gebruiken als vervanging voor de concentratie. In excel kunnen we nu mbv de afgeleide formule controleren of de gemeten waardes overeenkomen met de afgeleide waardes. Daarvoor moeten we de formule gebruiken om C (in dit geval de extinctie) te berekenen. De waarde van C0 is een geschatte waarde, de extinctie op tijdstip t = 0 en kunnen we uit de plot van E tegen t aflezen. Vervolgens maken we gebruik van een eenvoudige chi^2 toets en de solver in excel om de berekende curve te fitten op de meetwaarde. In de kolom D berekenen we het verschil tussen de gemeten en de berekende waarde en kwadrateren dit verschil. Vervolgens berekenen we de som van de D kolom. We gebruiken de solver in excel nu om de som van de chi-kwadraten te minimalizeren door de k-waarde in cel G5 te veranderen. De berekende waardes passen zich dan aan naar de beste fit. |
|
|
|
|
We kunnen zien dat de gemeten
en de berekende waarde niet erg goed overeenkomen hetgeen de conclusie
rechtvaardigt dat de kleurstof niet ontleedt volgens 1ste orde kinetiek.
De vraag is nu of we dat kunnen verklaren. |
|
Chloor, in de vorm van chloorbleekloog (natriumhypochloriet, NaOCl), is in Nederland maar ook daarbuiten, het meest gebruikte desinfectiemiddel aangezien het relatief eenvoudig in gebruik en goedkoop is. Door de oxiderende werking van chloor in het zwembadwater worden ziektekiemen, bacteriŽn en organisch 'afval' vernietigd. In Glorix zit chloorbleekloog, een oplossing van chloorgas (Cl2) in natronloog (NaOH). De hoeveelheid vrij chloor, gemeten als hypochlorigzuur (HOCl) en hypochloriet (ClO-) is ca. 5 mg/l. Het HOCl molecuul is als desinfectans een sterkere oxydant (80*) dan ClO- doordat het als elektrisch neutraal molecuul gemakkelijker in een micro-organisme kan binnendringen om vervolgens de inhoud van dat organisme te oxideren. De verschillende evenwichten die in een waterige hypochlorietoplossing blootgesteld aan lucht een rol kunnen spelen zijn weergeven in onderstaande figuur.
Op basis van deze gegevens lijkt het er dus op dat we hier niet met de reactie van een enkele component met de rode kleurstof te maken hebben maar met meerdere componenten (HOCl en ClO-) elk met hun eigen kinetiek. Misschien beide wel 1ste orde of pseudo 1ste orde maar met verschillende k. Daarnaast kunnen we met een complexe reactie te maken hebben en niet een eenvoudige A --> B reactie. Een voorbeeld van een dergelijke ontledingsreactie (ontleding van een humuszuur) is weergegeven in onderstaande figuur.
|
|
Conclusie:
|
Opmerkingen:
|
Literatuur:
Relevante websites: |
Achtergrondinformatie:
|
Colorimeter Een Colorimeter gebruiken we om de concentratie van een oplossing te bepalen door analyse van de kleurintensiteit. De Colorimeter meet de doorgelaten hoeveelheid licht door het monster bij een gekozen golflengte. Het licht van de LED passeert een cuvet met de oplossing. Een lichtgevoelige fotocel aan het uiteinde van de lichtweg detecteert de hoeveelheid doorgelaten licht (transmissie). De sensor biedt de volgende golflengtes: 635 nm (rood), 565 nm (groen), 470 nm (blauw) en 430 nm (violet). De concentratie van de testsubstantie kan worden bepaald met een curve volgens de wet van Beer, welke zegt dat de concentratie van een stof rechtevenredig is met de absorptie. |
|
Kinetiek Voor een 1ste orde reactie
geldt dat de snelheid recht evenredig is met de concentratie van een van
de reactanten. Reactie : A --> B De reactiesnelheid kunnen we dan omschrijven als:
-dCa/dt geeft aan dat C afneemt terwijl t toeneemt. k is de snelheidsconstante Op t=0 geldt dat C=C0
Bij verval wordt vaak het begrip halfwaarde-tijd (tĹ) gehanteerd. Dit is de tijd waarbij de helft van de oorspronkelijke concentratie is omgezet. Dus bij tĹ geldt dat: CĹ.C0
|
16-01-2017